
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Жұтылу жəне шығару спектрлерінің сипаттамасы
Əртүрлі жарық көзінен шыққан сəулені қарастырсақ, оларды сипаттайтын спектрлері түрліше болады.
Сиретілген газдар мен булардың шығаратын жарықтарының спектрлері жеке дискретті сызықтардан тұрады. Мысалы, инертті газдардың (гелий, неон, аргон сияқты), сутегі оттегі атомдарының жəне металл буларының жарығының спектрлері дискретті (жеке, дара) сызықтардан құралады. Ондай спектрлер сызықтық спектрлер деп аталады.
Ал, қызған қатты денелер мен сұйықтар шығаратын жарық сəулесінің спектрлері тұтас болады. Яғни, мұндай спектрді құрайтын толқындардың ұзындығы үздіксіз жалғасып бір түспен екінші түстің жігі білінбей кетеді. Олардың толқын ұзындықтарын жəй көзбен ажырату мүмкін емес. Мысалы, қызған темір, қызған электр лампасының, шамның жалынындағы қызған көмір бөлшектерінің жарықтарының спектрлері тұтасып кетеді, сондықтан оны тұтас спектр деп атаймыз.
Сызықтық спектрдің əрқайсысы белгілі бір монохрамат жарық толқын ұзындығына сəйкес келеді. Металдың булары мен инертті газдар жеке атомдардан құралғандықтан, олардың сызықтық спектрін дара атомдар береді, сондықтан ол атомдық спектрлер деп аталады. Атомның осы спектрлік сызықтары спектрдің көрінетін бөлігінде де, көрінбейтін инфраққызыл жəне ультракүлгін бөліктерінде де болады. Химиялық əртүрлі элементтердің атомдарының өздеріне тəн шығаратын спектрлері болады. Олар бір-біріне сəйкес келмейді.
Жарық шығарып тұрған қатты жəне сұйық денелердің жəне атомдық газдардың сызықтық спектрімен тұтас спектрін сəуле шығару спектрлері деп атаймыз.
Қызған, тұтас спектр беретін жарық көзінен тараған жарық, жолында тұрған заттан өткенде жарық спектрінің əр жерінде
~ 19 ~
бірнеше қара-қоңыр жолақтар пайда болады. Яғни, оларда тұтас спектрге қарағанда, интенсивті жолақ кескіндер пайда болатынын көреміз. Егер оны суретке түсірсек, онда фотопластинка бетінде бірнеше ақшыл жолақтар пайда болады. Осындай жұтылу сызықтарының немесе жұтылу жолақтарының жиыны жұтылу спектрі немесе жолақ спектр деп аталады. Жолақ спектрлер əртүрлі заттар үшін əрқилы, біріне-бірі ұқсамайды, спектрдің түрліше алқаптарына орналасады да, олардың интенсивтіктері əртүрлі болады. Кирхгоф заңы бойынща атомдардың сəуле шығару сызықтары олардың жұтылу сызықтарына сəйкес келеді.
Заттың буы арқылы ақ жарықты түсіргенде тұтас спектр бетінде қара-қоңыр сызықтар пайда болады. Осы қара-қоңыр сызықтар берілген химиялық элементтің шығару спектрінің сызықтарына дəл келеді. Сондықтан да бұл сызықтар жұтылу спектрі болып табылады.
Сызықтық спектр беретін сəулені төменгі қысымдағы атомдық газ атомдары, бір-бірімен əлсіз əсерлесу кезінде де шығарады.
Заттың сəуле шығаруы не жарық жұтуы, оның ішкі энергиясының өзгеруіне байланысты болады. Заттағы атомдар қозбаған негізгі күйде болса, заттың ішкі энергиясы да ең аз шамаға ие болады. Зат бөлшектеріне сырттан қосымша энергия берсек, олар оны жұтып, қалыпты немесе негізгі күйден қозған күйге көшеді. Атомдардың ішкі энергиясы үздіксіз өзгеріп отыруы мүмкін емес, ол секірмелі түрде, дискретті өзгереді. Олай болса, əр заттың молекулалары немесе əр элементтің атомдарының өздеріне тəн энергия күйлерінің белгілі дискрет мəндері болады. Сондықтан олар энергияны тек белгілі мөлшерде ғана жұтады немесе энергетикалық күйге көше алады. Энергия жұтқанда электрон (атом) төменгі энергетикалық деңгейден жоғарғы деңгейге, ал энергия шығарғанда жоғарғы энергетикалық деңгейден төменгі энергетикалық деңгейге ауысады. Əрбір элементтің атомдары тек өзіне сəйкес келетін энергетикалық деңгейлердің жүйесін ғана сипаттай алады (1.3-сурет).
~ 20 ~
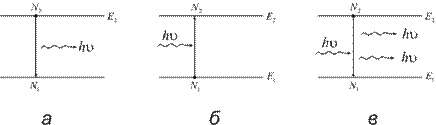
1.3-сурет
а) жағдайында атом өздігінен жарық шығару (фотон) нəтижесінде, екінші энергетикалық күйден, бірінші энергетикалық күйге спонтанды түрде көшеді. б) жағдайында берілген жарық квантын (һν) жұту нəтижесінде бөлшек (электрон) бірінші энергетикалық күйден екінші энергетикалық күйге еріксіз көшеді (резонанстық көшу). в) жағдайында берілген жарық квантын жұтып, жарық (фотон) шығарады да екінші энергетикалық деңгейден бірінші энергетикалық деңгейге еріксіз көшеді (индукцияланады).
Спектрдің ең төменгі деңгейі - бөлшектің қалыпты күйіне сəйкес келеді (Е0). Одан жоғары деңгейлердің əрқайсысы белгілі қозған күйлерге сəйкес Е1, Е2, Е3 жəне т.б. деңгейлерге орналасады.Бұл деңгейлерде атом мен молекуланың ішкі энергиясы көбірек болады. Бөлшекті негізгі деңгейден қозған деңгейге көшіруге жұмсалатын энергия қоздыру энергиясы деп аталады.
Date: 2015-07-24; view: 3237; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |