
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

арагонит кальцит
При охлаждении обратного перехода не происходит.
Реальные кристаллы. [3, стр. 306÷311].
Дефекты кристаллической решётки.
Отметим, что в идеальной структуре положение ионов в решётке соответствует минимальному значению энергии кристалла. Такое состояние отвечает требованию ближнего и дальнего порядков.
Реальные кристаллы отличаются тем, что в них не все ионы находятся в положениях, отвечающих минимуму энергии, вследствие того, что в кристалле появляются нарушения ближнего и дальнего порядков. Эти отклонения от идеального расположения ионов в кристалле называют дефектами (несовершенствами). Все реальные кристаллы содержат дефекты в той или иной степени.
Дефекты по характеру их природы можно разделить на следующие группы: точечные дефекты; линейные дефекты, или дислокации; поверхностные дефекты (границы фаз); объёмные дефекты (пустоты, включения другой фазы).
По энергетическому состоянию дефекты могут быть равновесными и неравновесными. Равновесными называют дефекты, находящиеся в термодинамическом равновесии со структурой. К ним относят точечные дефекты. Неравновесными называют дефекты, не находящиеся в равновесии со структурой и вследствие этого имеющие более высокие значения энергии. К ним относят дислокации, поверхностные и объёмные дефекты.
Равновесные дефекты. Точечные дефекты в ионных кристаллах.
Реальные кристаллы могут содержать два типа дефектов: дефекты по Френкелю[12] и дефекты по Шоттки[13].

Рис. 9. Образование дефектов в кристаллической решётке: а – кристалл с дефектами по Френкелю; б – идеальный кристалл; в – кристалл с дефектами по Шоттки [3, стр. 307].
Дефекты по Френкелю. Катион или анион перемещается из своего нормального равновесного положения (узла) в промежуточное положение (междоузлие), образуя ион внедрения и вакансию, т.е. незанятый узел решётки (рис. 9а). Дефекты в виде катионов в междоузлиях и катионных вакансий более распространены, чем дефекты в виде анионов в междоузлиях и анионных вакансий.
Дефекты по Шоттки. Катион и анион перемещаются из своих нормальных равновесных положений на поверхность кристалла, образуя катионную и анионную вакансии в равных количествах (рис. 9в).
Теперь рассмотрим причины, вызывающие образование дефектов.
Повышение температуры (тепловые дефекты). Даже в идеальном при 0 К кристалле с повышением температуры возникают дефекты. Это происходит потому, что повышение температуры способствует перемещению ионов кристалла на его поверхность (дефекты по Шоттки), смещению ионов в промежуточные положения (дефекты по Френкелю), а также взаимному замещению ионами друг друга в решётке кристалла.
Примеси (примесные дефекты). В узлах решетки часть основных ионов заменена ионами примеси – твёрдые растворы замещения, или ионы примеси находятся в промежуточных положениях решётки – твёрдые растворы внедрения.
Можно сказать, что наличие тех или иных дефектов в реальных кристаллах определяется условиями образования этих кристаллов. Установлено, что дефекты влияют на электрические, магнитные и оптические свойства кристаллов и что химические реакции в твёрдых фазах протекают благодаря присутствию дефектов.
Применяемые на практике материалы даже чисто кристаллического строения в подавляющем большинстве случаев представляют собой или мелкокристаллические порошкообразные продукты, или системы, состоящие из большого числа мелких кристаллов (поликристалличность), одинаковых или различных по составу, связанных в одно твёрдое тело, как это имеет место, например, в металлических сплавах и в большей части горных пород. При этом нередко кристаллы основных веществ разделяются тонкой прослойкой, содержащей различные примеси. Поверхность кристалла часто обладает мозаичной структурой, т.е. состоит из отдельных участков (блоков), несколько различно ориентированных или разделённых один от другого трещинами. [1, стр. 143÷144].
Неравновесные дефекты. Линейные дефекты или дислокации.
Дислокациями называют линейные нарушения в решётке кристалла. Дислокации бывают двух видов: краевые и винтовые.
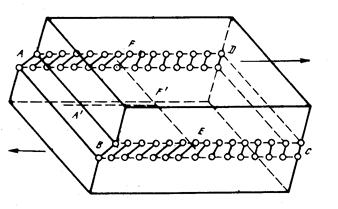
Рис. 10. Краевая дислокация в плоскости скольжения ABCD. В области ABEF ионы смещены более чем наполовину величины постоянной решётки; в области FECD ионы смещены менее чем на половину постоянной решётки. EF – линия дислокации. A’F’ – направление скольжения [3, стр. 310].
Краевые дислокации. Рассмотрим кристалл, в котором верхний слой ионов сдвинут на одно межионное расстояние в левой части плоскости скольжения (рис. 10). Граница между той частью кристалла, где произошёл сдвиг, и той частью, где сдвиг не произошёл, представляет собой дислокацию, являющуюся, таким образом, линейным дефектом кристаллической решётки, наибольшая деформация которой происходит вблизи дислокации. Краевая дислокация простирается в плоскости скольжения по всему кристаллу в направлении, перпендикулярном к направлению скольжения.
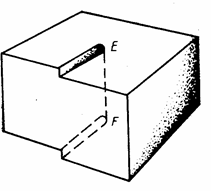 Винтовые дислокации. Схематическое изображение винтовой дислокации дано на рис. 11, где указана граница между смещённой и
Винтовые дислокации. Схематическое изображение винтовой дислокации дано на рис. 11, где указана граница между смещённой и
несмещённой частями кристалла, расположенная параллельно направлению скольжения, а не перпендикулярно к нему, как при краевых дислокациях. Образование винтовой дислокации можно себе представить, если сделать в кристалле разрез и сдвинуть вниз на одно межионное расстояние часть кристалла, расположенную справа от разреза. Вертикальная линия EF – линия дислокации; вблизи этой линии происходит наибольшая деформация
Рис. 11. Винтовая дислокация решётки. При винтовой дислокации атомные
[3, стр. 311]. плоскости в кристалле расположены по спирали,
так что при каждом обороте вокруг линии дислокации происходит перемещение на одно межплоскостное расстояние по линии дислокации.
Краевые и винтовые дислокации относятся к неравновесным дефектам. Неравновесные дефекты способны взаимодействовать с равновесными. Так, дислокации могут поглощать и снова создавать вакансии.
Дислокации оказывают влияние на физические свойства кристаллов. Например, механическая прочность и пластическая деформация кристаллов обусловлены наличием дислокаций. Возникновение дислокаций происходит путём накопления в кристалле точечных дефектов (ионов в промежуточных положениях и вакансий). Дислокации могут быть вызваны неравномерным ростом кристалла, механическими и термическими напряжениями, а также наличием примесей.
Температуры и теплоты плавления кристаллов. [1, стр. 150÷152].
Температура плавления кристаллов данного вещества зависит от внешнего давления, от присутствия примесей и для высокодисперсных порошков – также от степени дисперсности[14]. Эти зависимости мы будем рассматривать позднее; здесь же ограничимся температурами плавления только чистого вещества и только при атмосферном давлении. Температура плавления при атмосферном давлении называется также точкой плавления. Её называют иначе температурой (или точкой) отвердевания данного вещества. Для веществ с низкой температурой плавления (ниже 15÷20ºС) её называют также температурой (точкой) замерзания.
Табл. 1 [1, стр. 150].
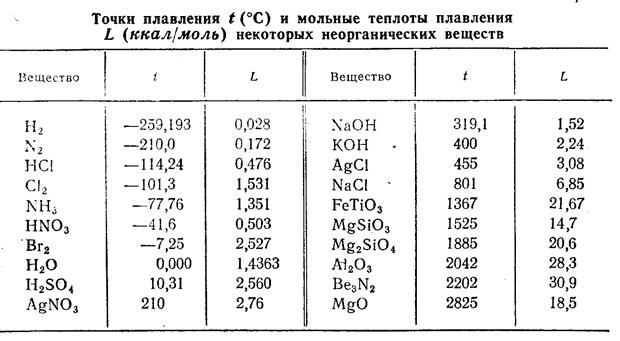
Наиболее низкой точкой плавления обладают молекулярные кристаллы, так как в них связь между частицами, образующими решётку, наиболее слабая (табл. 1). Среди кристаллов, структура решётки которых обуславливается ионной или ковалентной связью, редко встречаются плавящиеся ниже 300ºС (если исключить случаи плавления кристаллогидратов некоторых солей в своей кристаллизационной воде) и, наоборот, молекулярные кристаллы с точкой плавления выше 300ºС почти отсутствуют.
Из отдельных закономерностей отметим, что в молекулярных кристаллах неполярных веществ точка плавления, в общем, повышается с увеличением размера молекулы, хотя и не всегда плавно. С увеличением полярности молекул, а в особенности с образованием водородной связи в кристаллах, точка плавления повышается. Ионные кристаллы, состоящие из двухзарядных ионов, обладают более высокой точкой плавления, чем кристаллы, состоящие из однозарядных ионов.
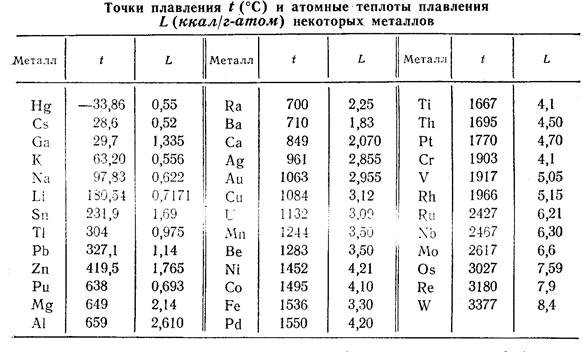
Как видно из данных табл. 2, точки плавления металлов значительно различаются. Если не считать ртути и галлия, то наиболее низкими точками плавления обладают щелочные металлы, так как в них атомы отдают для связи только по одному электрону. Бóльшая же часть металлов обладает высокими точками плавления – выше 800ºС (в табл. 2 помещена лишь часть из них).
Табл. 2 [1, стр. 152].
 Наиболее высокими температурами плавления обладают некоторые группы кристаллов с атомной решёткой. Сюда относятся многие карбиды, силициды, нитриды и бориды металлов. Плавление кристаллов происходит при той температуре, при которой тепловое движение частиц, усиливающееся при нагревании, становится способным в той или другой степени преодолевать взаимное притяжение частиц. Здесь речь идёт о колебательном движении частиц, образующих кристаллическую решётку, и о взаимном притяжении между этими частицами.
Наиболее высокими температурами плавления обладают некоторые группы кристаллов с атомной решёткой. Сюда относятся многие карбиды, силициды, нитриды и бориды металлов. Плавление кристаллов происходит при той температуре, при которой тепловое движение частиц, усиливающееся при нагревании, становится способным в той или другой степени преодолевать взаимное притяжение частиц. Здесь речь идёт о колебательном движении частиц, образующих кристаллическую решётку, и о взаимном притяжении между этими частицами.
Теплотой плавления называется количество энергии,
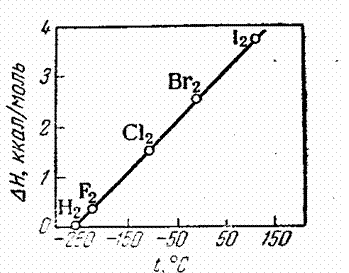
Рис. 12. Зависимость между температурами необходимое для плавления
плавления и теплотами плавления галоге- вещества при постоянной
нов и водорода (по М.Х. Карапетьянцу). температуре. Мы будем относить
[1, стр. 151]. её к одному молю вещества. Хотя
однозначной связи между теплотами плавления и температурами плавления нет, однако теплоты плавления бывают, в общем, тем бóльшими, чем выше температуры плавления. Особенно это относится к веществам, близким между собой по классу соединения и по характеру связи.
Для них нередко наблюдается (рис. 12) и приближённая пропорциональная зависимость между теплотой и температурой плавления (при выражении последней в градусах абсолютной шкалы – ºК). Чем больше энергия взаимного притяжения, тем в общем выше и температура плавления. Однако между этими величинами нет простой связи, так как здесь сказывается влияние и других факторов, в особенности, если не ограничиться сравнением веществ, сходных по составу. Межмолекулярное притяжение, действующее в кристаллах с молекулярной решёткой, преодолевается тепловым движением уже при умеренных температурах. Для преодоления кулоновского притяжения частиц в ионных кристаллах требуется более высокая температура. При плавлении кристаллов с атомной решёткой тепловое движение должно преодолевать силы ковалентных химических связей. Прочность их для разных веществ различна в широких пределах. Естественно, что кристаллы с прочными ковалентными связями обладают наиболее высокими температурами плавления.
Теплоёмкость кристаллов.
Ещё в начале XIX века было установлено эмпирическое правило (закон Дюлонга [15] и Пти [16] ), согласно которому атомная изобарная теплоёмкость Ср при комнатных и более высоких температурах для различных простых веществ в кристаллическом состоянии одинакова и равна приблизительно 6,3 кал/(град·моль)или 25 Дж/моль·К.
Хотя многие элементы приближённо удовлетворяют указанной закономерности, обладая теплоёмкостью, равной 6,1÷6,8 кал/град·моль, однако известно немало значительных отступлений у лёгких элементов, в особенности у неметаллов. Так, атомная теплоёмкость бор равна 2,65, бериллия 3,93, кремния 4,78, алмаза 1,46 кал/град·моль.
Для изохорной теплоёмкости Сv постоянство соблюдается несколько лучше. Для многих элементов, порядковый номер которых больше 19
Cv = 3R = 5,9 ± 0,09 кал/град·моль (1)
Для лёгких же элементов, особенно неметаллов, изохорная теплоёмкость тоже нередко сильно отклоняется от этого значения.
Природа указанных отступлений становится яснее, если сопоставить значения теплоемкостей разных веществ при различных температурах, как это сделано на рис. 13. Теплоёмкость всех веществ сильно уменьшается в области
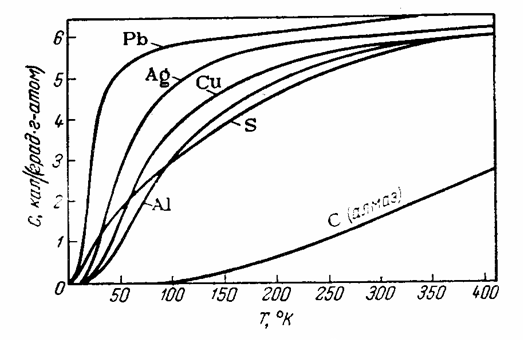
Рис. 13. Зависимость теплоёмкостей некоторых кристаллических веществ от температуры [1, стр. 153].
очень низких температур и становится раной нулю при 0ºК. Для элементов, Ср которых при комнатных температурах мало отличается от 6,3, сильное уменьшение теплоёмкости происходит при температурах значительно ниже комнатной; для других же веществ уменьшение теплоёмкости наблюдается и при более высоких температурах, так что теплоёмкость алмаза достигает, например, значения 5,16 кал только к 1200ºС.
Следует привести одно грубо приближённое соотношение, иногда полезное при ориентировочных расчётах. Это соотношение устанавливает, что
мольная теплоёмкость сложных веществ в кристаллическом состоянии равна сумме атомных теплоёмкостей входящих в них элементов, т.е. является величиной аддитивной.
Если молекула вещества содержит n атомов, то, пользуясь равенством (1), это соотношение можно выразить формулой
СV = 5,9 · n (2)
Мы не можем непосредственно измерять теплоёмкость твёрдых тел, сохраняя объём постоянным. Поэтому во многих случаях возникает необходимость расчёта Cv по значениям Ср или, наоборот, расчёта Ср по теоретическим значениям Cv. Для твёрдых тел разность Cp – Cv невелика и обычно меньше 0,5· n кал/град·моль, где n – число атомов в молекуле, считая по брутто-формуле.
Практически Ср можно определять по формуле
Ср = 6,2 · n (3)
При расчётах для элементов, теплоёмкость которых значительно отличается от 6,2, лучше воспользоваться следующими составляющими изобарной теплоёмкости.
Элемент C H B Si O F P S
Cp, кал/град·моль 1,8 2,3 2,7 3,8 4,0 5,0 5,4 5,4
Так, для СаСО3 расчёт Ср [ кал/град·моль ] даёт:
Са................................................................................... 6.2
С..................................................................................... 1,8
3О................................................................................. 12,0
__________________________________________________
СаСО3........................................................................... 20,0
а экспериментальное значение Ср = 19,6 при 25ºС. Впрочем, часто расхождения бывают значительно бóльшими и достигают 10÷12%.
ЛИТЕРАТУРА
1. Киреев В.А.; Краткий курс физической химии; изд. 4-е, доп. и перераб.;
Химия, М., 1969; 640 стр.
2. Химический энциклопедический словарь; Советская энциклопедия, М., 1983;
792 стр.
3. Общая химия; под ред. Е.М. Соколовской, Г.Д. Вовченко, Л.С. Гузея; изд.
2-е, перераб. и доп.; Изд-во МГУ, 1980; 726 стр.
4. Гороновский И.Т., Назаренко Ю.П., Некряч Е.Ф.; Краткий справочник по
химии; изд. 5-е испр. и доп.; Наукова думка, Киев, 1987; 830 стр.
5. Справочник по химии цемента; под ред. Б.В. Волконского и Л.Г. Судакаса;
Стройиздат, Л., 1980; 224 стр.
6. Гончаров А.И., Корнилов М.Ю.; Справочник по химии, Вища школа, Киев,
1977; 304 стр.
7. Фолта Я., Новы Л.; История естествознания в датах. Хронологический обзор,
Прогресс, М., 1987; 495 стр.
8. Волков В.А., Вонский Е.В., Кузнецова Г.И.; Выдающиеся химики мира.
Биографический справочник, Высшая школа, М., 1991; 656 стр.
[1] Кристаллическое состояние – равновесное состояние твёрдых тел, характеризующееся анизотропией макроскопических свойств. Основной признак кристаллического состояния на микроскопическом уровне – наличие дальнего порядка, т.е. трёхмерной периодичности в расположении частиц (сравни с аморфным состоянием). В так называемых пластичных кристаллах дальний порядок распространяется лишь на положения центра тяжести молекул; в отношении ориентации молекул трёхмерная периодичность отсутствует. В ориентационно-разупорядоченном состоянии могут находиться не только целые молекулы, но и отдельные их фрагменты (например, метильные группы). В жидкокристаллическом состоянии вещество обладает свойствами как жидкостей, так и кристаллов.
Стабильная структура кристалла определяется температурой и давлением; их изменение может приводить к полиморфным превращениям. При быстром изменении внешних условий, а также при наличии примесей, тормозящих структурную перестройку, могут быть получены неравновесные (метастабильные) модификации вещества, иногда сохраняющиеся в течение длительного времени.
Большинство природных и используемых в технике искусственных твёрдых веществ находится в поликристаллическом состоянии, т.е. представляет собой совокупность беспорядочно ориентированных мелких кристаллов (зёрен), размер которых зависит от условий кристаллизации, содержания примесей, термообработки и др. В поликристаллическом состоянии анизотропия свойств проявляется лишь при наличии преимущественной ориентации отдельных зёрен (текстуры). В технике широко используют также более или менее крупные монокристаллы. Реальные кристаллы всегда содержат различного рода дефекты.
Твёрдые полимеры не могут, как правило, быть получены в чисто кристаллическом состоянии и всегда содержат ту или иную долю аморфной фракции. В отличие от молекул низкомолекулярных веществ макромолекулы обычно входят в кристалл в многократно сложенном виде. Для некоторых блоксополимеров наблюдаются специфические кристаллические структуры, образованные аморфными элементами, упакованными в правильном трёхмерном порядке [2, стр. 287].
[2] Аморфное состояние – одно из физических состояний конденсированных тел, характеризующееся наличием только ближнего порядка. Это означает, что взаимное расположение любых двух, трёх и более частиц в аморфном теле является скоррелированным (согласованным). Из-за отсутствия дальнего порядка аморфные тела изотропны, т.е. их макроскопические свойства в отсутствие внешних воздействий не зависят от направления. По сравнению с кристаллом того же вещества аморфное тело обладает бóльшими объёмом и энтропией. Устойчивое состояние аморфных тел – жидкость, всё твёрдые аморфные тела метастабильны и могут рассматриваться как переохлажденные жидкости. Характерный признак твёрдых аморфных тел – плавление в некотором температурном интервале. Этим они отличаются от поликристаллов, которые также изотропны, но плавятся при фиксированной температуре.
Существование твёрдых аморфных тел объясняется тем, что кристаллизация требует определённой переупаковки молекул, которая может быть затруднена кинетически, если молекулы громоздки (как в случае полимеров), а скорость охлаждения (или сжатия) слишком велика. Аморфные полимеры могут находиться в трёх физических состояниях, отличающихся друг от друга характером теплового движения макромолекул. При низких температурах для них характерно стеклообразное состояние, в котором отсутствуют перемещения как самих молекул, так и их сегментов. При нагревании выше температуры стеклования аморфные полимеры переходят в высокоэластическое состояние, в котором «размораживается» движение отдельных сегментов макромолекул. И, наконец, в вязкотекучем состоянии перемещаются как отдельные сегменты, так и сами макромолекулы. Характерная особенность аморфных полимеров – способность макромолекул образовывать различного рода агрегаты. Эти структуры могут обнаруживать трёхмерный порядок несмотря на то, что составлены из аморфных элементов. Структурные превращения на надмолекулярном уровне, как правило, затруднены, но могут быть ускорены нагреванием, введением пластификаторов, действием внешних сил
[2, стр. 44].
[3] Полиморфизм – способность твёрдых веществ и жидких кристаллов существовать в двух или нескольких формах с различной кристаллической структурой и свойствами. Такие формы называются полиморфными модификациями. Взаимные превращения этих модификаций называют полиморфными переходами. Полиморфизм простых веществ принято называть аллотропией, но понятие полиморфизма не относится к некристаллическим аллотропным формам (например, газообразным О2 и О3).
Полиморфизм широко распространен. Типичный пример – модификации углерода: алмаз, лонсдейлит, графит. Полиморфизм молекулярных кристаллов проявляется в различной упаковке молекул, имеющих одинаковую структурную формулу; переход от одной модификации к другой происходит без разрыва ковалентных связей, но конформация молекул может существенно изменяться (конформационный полиморфизм). Известны полиморфные модификации, отличающиеся степенью упорядоченности. Например, в высокотемпературной форме бензтиофена, существующей выше -11°С, в отличие от низкотемпературной молекулы статистически занимают четыре различных положения. Особый вид полиморфизма связан со свободным вращением молекул или атомных группировок. Так, в кристаллах NH4NO3 при 84°С происходит переход, обусловленный возникновением вращения ионов NO3- вокруг оси третьего порядка; в интервале от 125°С до температуры плавления ионы NO3- и NH4+ вращаются вокруг центров масс, эффективно приобретая сферическую форму.
Частный случай полиморфизма – политипия (политипизм); политипные модификации представляют собой различные варианты наложения одинаковых двумерных структурных фрагментов; при этом два параметра решётки неизменны, а третий меняется, оставаясь кратным постоянной величине. Характерный пример – SiC, для которого известно более 40 модификаций.
Полиморфные модификации обычно являются термодинамическими фазами. Если каждая из двух модификаций устойчива в определённом интервале температур и давлений, фазы называются энантиотропными. В принципе одна из них должна переходить в другую при вполне определённых условиях, и превращение должно осуществляться в любом направлении. Однако энантиотропные превращения могут быть настолько кинетически заторможены, что метастабильная модификация существует неограниченно долго. Например, алмаз и многие другие минералы метастабильны при атмосферном давлении и комнатной температуре. Некоторые же полиморфные переходы протекают настолько быстро, что можно визуально наблюдать растрескивание кристалла или движение границы раздела фаз. Если одна из двух модификаций термодинамически неустойчива при всех температурах ниже температуры плавления, эти две модификации называются монотропными. Для них осуществим только односторонний переход метастабильной формы в стабильную. Первую можно получить лишь из переохлаждённой жидкости. При энантиотропии каждой из двух модификаций соответствует определённая область существования на диаграмме состояния; при монотропии такая область имеется лишь для устойчивой модификации.
Полиморфные переходы могут быть первого и второго рода. При переходе второго рода изменение кристаллической структуры невелико, а иногда и вовсе отсутствует (например, при переходе α-Fe в β-Fe при 769°С структура практически не изменяется, однако ферромагнитные свойства пропадают). Ко второму роду часто относятся также переходы типа порядок-беспорядок, переходы с появлением внутреннего вращения
[2, стр. 464].
[4] Аллотропия – явление существования химического элемента в виде двух или нескольких простых веществ, различных по строению и свойствам (так называемых аллотропных форм). Может быть обусловлено образованием молекул с различным числом атомов (например, О2 и О3) или разной структурой кристаллов (например, графит и алмаз). В последнем случае аллотропия – разновидность полиморфизма [2, стр. 26].
[5] Слюды – природные алюмосиликаты слоистой структуры; общая формула AB[AlSi3O10](OH, F)2, где A = K, Na; B = Al, Mg, Fe, Li. Основные представители:
мусковит KAl2[AlSi3O10](OH)2
флогопит KMg3[AlSi3O10](OH, F)2
биотит K(Mg, Fe)3[AlSi3O10](OH, F)2
лепидолит KLi2Al[Al3O10](OH, F)2
цинвальдит KLiFeAl[AlSi3O10](OH, F)2
Кристаллы пластинчатые, способны расщепляться на тонкие, упругие и прочные листочки. Плохо растворимы в воде, устойчивы к действию водных растворов кислот и щелочей; при сплавлении со щелочами и карбонатами щелочных металлов разлагаются. Применение: электро- и теплоизоляционный материал; лепидолит и цинвальдит – сырьё в производстве Li и его соединений, из лепидолита изготавливают также специальные оптические стёкла; молотые слюды – наполнители в производстве пластмасс, красок, резины, строительных материалов. Мировая добыча слюд для электроизоляционных целей 35 тыс. т/год (1978). Разработано промышленное получение слюд медленным охлаждением фторсиликатных расплавов соответствующего состава; синтетические слюды – высококачественный электроизоляционный материал
[2, стр. 532]
[6] Сера – т.пл. 112,8°С (ромбическая), 119,25°С (ромбическая) (в обоих случаях в виде S8) [4, стр. 50].
Йод – т.пл. 113,5°С [4, стр. 44]. СО2 - т.пл. -56,6°С (0,5 мПа); т.кип. -78,5 (возгоняется) [4, стр. 76].
[7] CsCl – т.пл. 642°С; т.кип. 1300°С [4, стр. 97]. NaCl – т.пл. 800,8°С; т.кип. 1413°С [4, стр. 166].
[8] Алмаз – сгорает при 870°С в присутствии кислорода [2, стр. 26]; возгоняется при 3700°С [4, стр. 40].
[9] Квасцы – кристаллогидраты двойных сульфатов общей формулы M2ISO4·M2III(SO4)3·24H2O или MIMIII(SO4)2·12H2O, где МI – одновалентный (Na, K, Rb, Cs, NH4, Tl и др.), а МIII – трёхвалентный (Al, Ga, In, V, Cr, Fe, Co и др.) металл. Трёхвалентные редкоземельные элементы квасцов не образуют. Квасцы относят к комплексным соединениям с очень небольшой степенью устойчивости комплексных ионов. Квасцы обладают вяжущим и кислым вкусом, хорошо растворяются в воде и в разбавленных растворах практически полностью диссоциируют на простые ионы:
KAl(SO4)2 = K+ + Al3+ + 2SO42–
Квасцы получают смешением горячих водных растворов соответствующих сульфатов. Применяют преимущественно алюмокалиевые квасцы как дубильное вещество в кожевенной и фотопромышленности, в качестве протравы в текстильной промышленности при крашении тканей, в бумажной промышленности для проклеивания бумаги, в медицине как вяжущее, подсушивающее и дезинфицирующее средство для слизистой оболочки и кожи, прекращения кровотечения, при порезах и др. [6, стр. 124÷125].
[10] Арагонит (λ-СаСО3) – известковый шпат. Состав: 56, 04% СаО, 43,96% СО2. Примеси: Sr (до 5,6%), Mg, Fe, Zn (образуют с ним двойные соли).
Арагонит представляет собой метастабильную фазу, постепенно переходящую при обычной температуре в кальцит. Кристаллизуется в ромбической системе, ионы Са2+ и (СО3)2– в его решётке упакованы по принципу плотнейшей гексагональной упаковки. Поэтому кристаллическая структура у арагонита более плотная, чем у кальцита.
Форма кристаллов псевдогексагональная, призматическая или игольчатая. Арагонит образует двойники, тройники, радиально-лучистые (звёздчатые) сростки и шаровидные зёрна. Отрицательный, двухосный, ng = 1,685 и np = 1,530, в шлифе бесцветный. Отличить от кальцита в шлифе очень трудно. Арагонит характеризуется несколько большими твёрдостью, плотностью и растворимостью в воде, чем кальцит (плотность 2,9÷3,0 г/см3, твёрдость 3,5÷4,0) [5, стр. 16÷17].
[11] Кальцит (СаСО3) – известковый шпат. Химический состав, %: СаО 56.04, СО2 43,96. Примеси в кальците – Mg, Fe, Mn (до 8%), Sr образуют с ним двойные соли.
Кристаллизуется в тригональной системе. Ячейка гранецентрированная, содержит две молекулы СаСО3 и имеет форму ромбоэдра с а = 6,41 Å и α = 46º7'. Упаковка ионов в кальците несколько искажённая кубическая, т.е. весьма плотная. Внутри элементарной ячейки находятся две группы СО3, состоящие из центрального атома углерода и трёх атомов кислорода, расположенных в вершинах треугольника, плоскость которого перпендикулярна тройной оси. Расстояние С–О приблизительно равно 1,24 Å.
Внешний вид кристаллов кальцита, образовавшихся в благоприятных условиях, довольно разнообразен. Кристаллы большей частью бесцветные или молочно-белые. В породе кристаллизация минерала в основном недостаточно отчётлива, часто наблюдаются двойники.
Минерал одноосный, отрицательный с n0 = 1,658 и nl = 1,486. Твёрдость3, хрупок. Плотность 2,6÷2,8 г/см3 [5, стр. 80].
[12] Френкель, Яков Ильич (1894–1952) – советский физик-теоретик [7, стр. 432].
[13] Шоттки Вальтер (Schottky W. 1886–1976), немецкий физик, уроженец Швейцарии [7, стр. 439].
[14] Дисперсность – характеристика размеров частиц дисперсной фазы в дисперсных системах. Усреднённый показатель дисперсности – удельная поверхность; более полное представление о дисперсности даёт кривая распределения объёма или массы дисперсной фазы по размерам частиц, которую строят на основании данных дисперсионного анализа; максимум на кривой соответствует вероятнейшему размеру частиц. Соотношение количеств частиц различного размера в данной системе определяет её полидисперсность. Системы с частицами практически одинакового размера называются монодисперсными. Дисперсность гомогенных полимерных систем связана с молекулярной массой макромолекул, а полидисперсность в этом случае является синонимом молекулярно-массового распределения [2, стр. 180]
[15] Дюлонг Пьер Луи (12.II.1785–19.VII.1838). Французский химик и физик.
[16] Пти, Алексис Терез (1791–1820). Французский физик.
Date: 2015-05-22; view: 1067; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |