
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Физические и химические свойства
Гидроксикислоты – жидкости или большей частью кристаллические вещества. В воде они растворимы лучше, чем соответствующие карбоновые кислоты, не содержащие гидроксила. Низшие гидроксикислоты смешиваются с водой в любых соотношениях.
Гидроксикислоты проявляют свойства кислот и спиртов. Как кислоты они дают соли, сложные эфиры, амиды и т.д.:
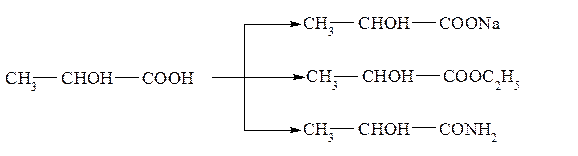
По сравнению с карбоновыми кислотами с тем же числом углеродных атомов гидроксикислоты (в особенности α -гидроксикислоты) обнаруживают более сильно выраженные кислотные свойства. Так, константа диссоциации гликолевой кислоты в 8,5 раз больше, чем уксусной.
Как спирты гидроксикислоты образуют алкоголяты, простые эфиры, замещают гидроксил галогеном:
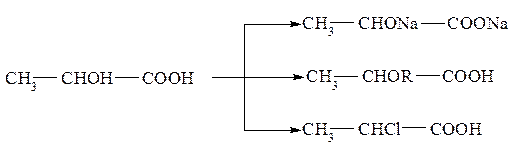
Вступление в реакцию спиртового или кислотного гидроксила определяется выбором реагента и условиями реакции. Так, при действии галогеноводородов замещается галогеном только спиртовой гидроксил, а при действии пентахлорид фосфора – и кислотный, и спиртовой. При действии щелочных металлов (натрий) сначала получаются соли кислот, а затем алкоголяты.
При всех превращениях гидроксикислот приходится считаться с взаимным влиянием гидроксильной и карбоксильной групп. Особенно это влияние велико, если эти группы находятся в α -положении. α -Гидроксикислоты обнаруживают ряд специфических реакций, обусловленных взаимным влиянием гидроксильной и карбоксильной групп.
3.1. Восстановление α-гидроксикислот.
α- гидроксикислоты легко восстанавливаются в карбоновые кислоты, например при действии иодистого водорода:
СН3―СНOH―COOH + 2HI → CH3―CH2―COOH + I2 + H2O
3.2. Нагревание α-гидроксикислот.
При кипячении с разбавленными кислотами α -гидроксикислоты расщепляются с выделением муравьиной кислоты:
СН3―СН(OH)―COOH → CH3―COН + HCOOH
3.3. Реакция дегидротации α-, β- и γ-гидроксикислот.
Реакция отщепления воды позволяет различить α -, β - и γ -гидроксикислоты.
Date: 2015-09-23; view: 516; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |